ПЛАТИНА
Кандидат химических наук В. Н. ПИЧКОВ
Химия и Жизнь №4, 1972 г., с. 14-23
 «Сей металл с начала света до сих времен совершенно оставался неизвестным, что без сомнения весьма удивительно. Дон Антонио де Уллоа, испанский математик, который сотовариществовал французским академикам, посланным от короля в Перу... есть первый, который упомянул об нем в известиях своего путешествия, напечатанных в Мадриде в 1748 году...
«Сей металл с начала света до сих времен совершенно оставался неизвестным, что без сомнения весьма удивительно. Дон Антонио де Уллоа, испанский математик, который сотовариществовал французским академикам, посланным от короля в Перу... есть первый, который упомянул об нем в известиях своего путешествия, напечатанных в Мадриде в 1748 году...Заметим, что вскоре по открытии платины, или белого золота, думали, что она не особенный металл, но смесь из двух известных металлов. Славные химики рассматривали сие мнение, и опыты их истребили оное...»
Так говорилось о платине в 1790 году на страницах «Магазина натуральной истории, физики и химии», издававшегося Московским университетом.
Человечество знакомо с платиной больше двух веков. Она быстро нашла применение - как драгоценный металл.
В наше время платина не просто драгоценный металл. Один из организаторов советской платиновой промышленности профессор Орест Евгеньевич Звягинцев сравнивал значение платины для современной техники со значением соли при приготовлении пищи — нужно немного, но без нее не приготовить обеда... Ежегодная мировая добыча платины исчисляется всего-навсего тоннами, но самые разнообразные области современной науки и техники без платины существовать не могут.
ПРОШЛОЕ ПЛАТИНЫ
«Белое золото», «гнилое золото», «лягушачье золото»... Под этими названиями платина фигурирует в литературе XVIII века. Этот металл известен давно, его белые тяжелые зерна иногда находили при добыче золота. Но их никак не могли обработать, и оттого долгое время платина не находила применения. Вплоть до XVIII века этот ценнейший металл вместе с пустой породой выбрасывали в отвалы. На Урале и в Сибири зерна самородной платины использовали как дробь при стрельбе. А в Европе первыми воспользовались платиной нечистые на руку ювелиры и фальшивомонетчики. Во второй половине XVIII века платина ценилась в два раза ниже, чем серебро. А удельный вес ее велик - 21,5 г/см3; с золотом и серебром она хорошо сплавляется. Пользуясь этим, платину стали подмешивать к золоту и серебру, сначала в украшениях, а затем и в монетах. Дознавшись об этом, испанское правительство объявило войну платиновой «порче». Был издан королевский указ, которым предписывалось уничтожать всю платину, добываемую попутно с золотом. В соответствии с этим указом чиновники монетных дворов в Санта-Фе и Папаяне (испанские колонии в Южной Америке) торжественно, при многочисленных свидетелях периодически топили накопившуюся платину в реках Боготе и Кауке. Только в 1778 году этот закон был отменен, и испанское правительство стало само подмешивать платину к золоту монет... Переняли опыт!
Полагают, что первым чистую платину получил англичанин Р. Уотсон в 1750 году. В 1752 году после исследований Г. Т. Шеффера она была признана новым металлом.
В 70-х годах XVIII века были изготовлены первые технические изделия из платины (пластины, проволока, тигли). Их готовили, прессуя губчатую платину при высоких температурах. Высокого мастерства в изготовлении платиновых изделий для научных целей достиг парижский ювелир Жаннети (1790 г.). Он сплавлял самородную платину с мышьяком в присутствии извести или щелочи, а затем при сильном прокаливании выжигал избыток мышьяка. Получался ковкий металл, пригодный для дальнейшей переработки.
В 1808-1809 годах во Франции и Англии (практически одновременно) были изготовлены платиновые сосуды почти в пуд весом - для получения концентрированной серной кислоты.
Появление подобных изделий и открытие ценных свойств элемента № 78 повысило спрос на него, иена на платину возросла, а это в свою очередь стимулировало новые исследования и поиски.
В России платина была впервые найдена на Урале в Верх-Исетском округе в 1819 году. При промывке золотоносных пород в золоте заметили белые блестящие зерна, которые не растворялись даже в сильных кислотах.
Бергпробирер лаборатории Петербургского горного корпуса В. В. Любарский в 1823 году исследовал эти зерна и установил, что «загадочный сибирский металл принадлежит к особому роду сырой платины, содержащей знатное количество иридия и осмия». В этом же году последовало высочайшее повеление всем горным начальникам искать платину, отделять ее от золота и представлять в Петербург. В 1824-1825 годах в Горно-Благодатском и Нижне-Тагильском округах были открыты чисто платиновые россыпи. В следующие годы платину на Урале нашли еще в нескольких местах. Уральские месторождения были исключительно богаты и сразу же вывели Россию на первое место в мире по добыче тяжелого белого металла. В 1828 году Россия добывала неслыханное но тому времени количество платины - 1550 кг в год, примерно в полтора раза больше, чем было добыто в Южной Америке за все годы с 1741 по 1825...
В 1826 году инженеры П. Г. Соболевский и В. В. Любарский разработали простой и надежный способ получения ковкой платины. Самородную платину растворяли в царской водке (3 части соляной кислоты и 1 часть азотной), а из этого раствора, добавляя NH4C1, осаждали хлорплатинат аммония (NH4)2[PtCl6]. Этот осадок промывали, а затем прокаливали на воздухе. Полученный спекшийся порошок (губку) прессовали в холодном состоянии, а затем прессованные брикеты прокаливали и ковали. Этот способ позволял делать из платины изделия высокого качества.
 21 марта 1827 г. в конференц-зале Петербургского горного кадетского корпуса на многолюдном торжественном собрании Ученого Комитета по Горной и Соляной части были показаны изготовленные новым методом первые изделия из русской платины - проволока, чаши, тигли, медали, слиток весом в 6 фунтов. Открытие П. Г. Соболевского и В. В. Любарского получило мировую известность. Им заинтересовался даже царь Николай I, посетивший лабораторию и наблюдавший опыты по очистке платины.
21 марта 1827 г. в конференц-зале Петербургского горного кадетского корпуса на многолюдном торжественном собрании Ученого Комитета по Горной и Соляной части были показаны изготовленные новым методом первые изделия из русской платины - проволока, чаши, тигли, медали, слиток весом в 6 фунтов. Открытие П. Г. Соболевского и В. В. Любарского получило мировую известность. Им заинтересовался даже царь Николай I, посетивший лабораторию и наблюдавший опыты по очистке платины.Благодаря предприимчивости министра финансов Е. Ф. Канкрина с 1828 года в России стали выпускать платиновую монету трех-, шести- и двенадцатирублевого достоинства. Стоимость платины в это время была в пять раз выше стоимости серебра, поэтому чеканка монеты стала стимулом для роста добычи платины на Урале. В 1843 году ее добыли уже 3500 килограммов...
Однако из-за колебаний цен на платину, из-за боязни подделки и ввоза платиновых монет из-за границы новый министр финансов Вронченко, сменивший Канкрина, прекратил чеканку платиновой монеты. По специальному указу в 1845 году вся платиновая монета в шестимесячный срок была изъята из обращения. Эта спешная паническая мера сразу же вызвала понижение цен на платину и резкий спад ее добычи. Другого применения платины в отсталой России найти не смогли. В конце сороковых годов на Урале добывали всего несколько пудов сырой платины в год, хотя среди изъятых платиновых монет не обнаружили ни одной поддельной и ни одной ввезенной из-за границы...
Здесь мы вынуждены вновь вернуться в Европу. В 1852-1857 годах французские ученые А. Сент-Клер Девиль и Ж. Дебре разработали способ выплавки больших количеств платины в пламени сгорающего в кислороде светильного газа. В изобретенной ими печи, выложенной пористым известняком, было углубление, в которое помещали губчатую платину или старые изделия из платины. В отверстие сверху вставлялась горелка по которой подавали газы - горючее и окислитель. В процессе плавления платины происходила дополнительная ее очистка. Примеси - железо, медь, кремний и другие - переходили в легкоплавкие шлаки и поглощались пористыми стенками печи. Расплавленная же платина выливалась через желобок в форму и затвердевала в слитки. Это изобретение преобразило металлургию платины, резко удешевило производство платиновых изделий и еще более повысило их качество.
Спрос и цена на платину на европейских рынках стали быстро повышаться. Однако в России открытие Сент-Клер Девиля и Дебре ничего не изменило. Теперь платиной интересовались только как продуктом экспорта. В 1867 году царский указ упразднил государственную монополию на платину и разрешил беспошлинный вывоз ее за границу. Воспользовавшись благоприятной конъюнктурой, Англия купила все запасы русской платины - более 16 тонн.
Продажа сразу такого громадного количества драгоценного металла резко понизила цены на платину на мировом рынке, и это не могло не сказаться на русской платиновой промышленности. Добыча платины стала менее выгодна, и постепенно, один за другим, уральские платиновые прииски стали переходить в руки английских, французских, немецких дельцов...
Перед первой мировой войной доля России в мировой добыче платины составляла 90-95%, но 9/10 этого количества уходили за границу, и лишь несколько процентов ее перерабатывалось в России на двух маленьких заводах.
Сразу же после Октябрьской революции были приняты меры для создания сильной платиновой промышленности. Уже в мае 1918 года был создан Институт по изучению платины, влившийся позже в Институт общей и неорганической химии, носящий ныне имя академика Н. С. Курнакова. В этом институте под руководством выдающихся ученых - Л. А. Чугаева, Н. С. Курнакова и И. И. Черняева - были выполнены многочисленные исследования по химии и металлургии платины и других благородных металлов. Результаты этих исследований стали научной основой нынешней мощной платиновой промышленности Советского Союза.
ПОЛУЧЕНИЕ ПЛАТИНЫ
Казалось бы, раз платина встречается в природе в самородном состоянии, получение ее не составляет особого труда. В действительности же это процесс сложный и многостадийный.
Платина - элемент редкий и в природе находится в рассеянном состоянии. Самородная платина обычно представляет собой естественный сплав с другими благородными и неблагородными металлами. Такая платина (ее называют сырой или шлиховой) встречается в россыпях в виде тяжелых зерен размером от ОД до 5 мм. Содержание элементарной платины в этом природном сплаве колеблется от 65 до 90%.
Самые богатые уральские россыпи содержали несколько десятков граммов сырой-платины на тонну породы. Такие россыпи очень редки, как, кстати, и крупные самородки. Сырую платину, подобно золоту, добывают из россыпей промыванием размельченной породы.
С приисков сырая платина поступает на аффинажный завод. Классический метод выделения платины заключается в длительном нагревании сырья в фарфоровых котлах с царской водкой. При этом почти вся платина и палладий, частично родий, иридий, рутений и основная масса неблагородных металлов (железо, медь, свинец и другие) переходят в раствор. В нерастворимом остатке содержатся кварц, осмистый иридий, хромистый железняк. Этот осадок отфильтровывают, повторно обрабатывают царской водкой, а затем отправляют на извлечение ценных компонентов - осмия и иридия.
Платина в растворе находится в виде двух комплексов - H2[PtCl6] - большая часть и (NO2)[PtCl6]. Добавляя в раствор соляную кислоту, разрушают комплекс (NO2)[PtCl6], чтобы вся платина перешла в форму H2[PtCl6]. Теперь можно, как это делал еще Соболевский, вводить нашатырь и осаждать элемент № 78 в виде хлорплатината аммония. Но прежде надо сделать так, чтобы присутствующие в растворе иридий, палладии, родий не ушли в осадок вместе с платиной. Чтобы перевести их в формы, не осаждаемые хлористым аммонием (Ir3+, Pd2+), раствор «доводят», прогревая его с кислотами (серной или щавелевой) либо (по способу И. И. Черняева) с раствором сахара.
Операция доводки - процесс трудный и тонкий. При недостатке восстановителя (кислота, сахар) осаждаемый хлорплатинат будет загрязняться иридием, при избытке же сама платина восстановится до хорошо растворимых соединений Pt2+ и выход благородного металла понизится.
Раствор хлористого аммония вводят на холоду. При этом основная часть платины в виде мелких ярко-желтых кристаллов (NH4)2[PtCl6] уходит в осадок. Основная же масса спутников платины и неблагородных примесей остается в растворе. Осадок дополнительно очищают раствором нашатыря и сушат. Фильтрат отправляют в другой цех, чтобы выделить из него драгоценные примеси сырой платины - палладий, родий, иридий и рутений. А осадок отправляют в печь. После нескольких часов прокаливания при температуре 800-1000° С получают губчатую платину в виде спекшегося порошка серо-стального цвета. Но и это еще не та платина, которая нужна. Полученную губку измельчают и еще раз промывают соляной кислотой и водой. Затем ее плавят в кислородо-водородном пламени или в высокочастотной печи. Так получают платиновые слитки.
Когда платину добывают из сульфидных медно-никелевых руд (содержание элемента № 78 в них не превышает нескольких граммов на тонну), источником платины и ее аналогов служат шламы цехов электролиза меди и никеля. Шламы обогащают обжигом, вторичным электролизом и другими способами. В полученных концентратах содержание платины и ее извечных спутников - платиноидов достигает 60%. Теперь их можно получать тем же путем, что из сырой платины.
Методы получения этих металлов из медно-никелевых руд, которыми богата наша страна, были разработаны группой ученых и инженеров. Многих из них уже нет в живых. Они сделали большое и очень важное для страны дело, и потому их имена должны быть названы в рассказе об элементе № 78. Это И. И. Черняев, В. В. Лебединский, О. Е. Звягинцев, Н. К. Пшеницын, А. М. Рубинштейн, Н. С. Селиверстов, П. И. Рожков, Ю. Д. Лапин, Ю. Н. Голованов, Н. Д. Кужель, Е. А. Блинова, Н. К. Арс-ланова, Н. Я. Башилов, И. С. Берсенев, Ф. Т. Киренко, В. А. Немилов, А. И. Степанов.
КОРОТКО О ХИМИИ ПЛАТИНЫ
Платину можно считать типичным элементом восьмой группы. Этот тяжелый серебристо-белый металл с высокой температурой плавления (1773,5° С), большой тягучестью и хорошей электропроводностью недаром отнесли к разряду благородных. В химические реакции он вступает достаточно трудно, не корроди-рует в большинстве агрессивных сред и всем своим поведением оправдывает известное изречение И. И. Черняева: «Химия платины — это химия ее комплексных соединений».
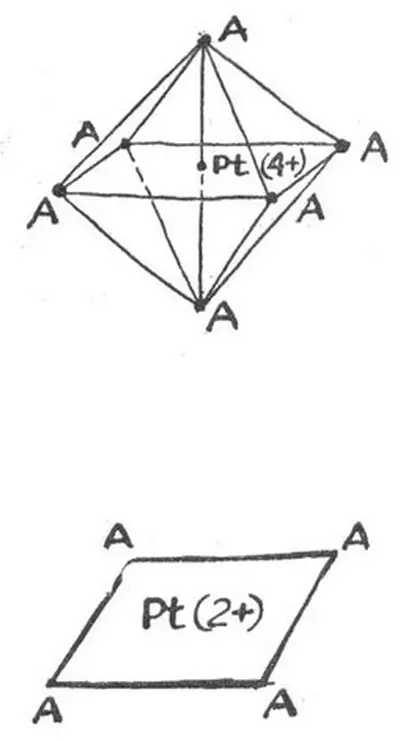
Как и положено элементу VIII группы, платина может проявлять несколько валентностей: 0, 2 + , 4 + , 5 + , 6+ и 8+. Но когда речь идет об элементе № 78 и его аналогах, почти так же, как валентность, важна другая характеристика - координационное число. Оно означает, сколько атомов (или групп атомов) - лигандов может расположиться вокруг центрального атома в молекуле комплексного соединения.
Наиболее характерная степень окисления платины в ее комплексных соединениях - 2+ и 4+ . А координационное число в этих случаях равно соответственно четырем или шести.
Лигандами могут быть различные кислотные остатки (Сl-, Br-, I-. NO2-, NO3-, CN-, С2О42-, CNS-), нейтральные молекулы простого и сложного строения (Н2О, NH3, C5H5N, NH2OH, (CH3)2S, C2H6SH) и многие другие неорганические и органические группы.
Химия комплексных соединений платины разнообразна и сложна. В этой сложной области науки советские исследователи неизменно шли и идут впереди. Характерно в этом смысле высказывание известного английского химика Дж. Чат-та (1960 год):
«Возможно, не случайно было и то, что единственная страна, которая посвятила значительную часть своих усилий разработке координационной химии, была и первой страной, пославшей ракету на Луну».
Способность платины образовывать многочисленные и разнообразные комплексы - главная причина широкого применения элемента № 78 в качестве катализатора.
ПЛАТИНА И СВЯЗАННЫЙ АЗОТ
В начале нашего века в газетах, журналах и серьезных научных трудах стали появляться мрачные прогнозы о грядущем всеобщем голоде и вообще о гибели цивилизации. Причиной таких прогнозов было истощение запасов чилийской селитры - главного в то время азотного удобрения и сырья для производства азотной кислоты. Проблема азота встала со всей остротой. Единственным реальным источником сырья для получения связанного азота оставался азот воздуха, который уже умели окислять, но только в пламени вольтовой дуги. В 1902 году неподалеку от знаменитого Ниагарского водопада построили большой завод. Днем и ночью горели, «сжигая» азот, 185 дуг. Выход окислов азота был, однако, ничтожен - всего около 2%, а расход энергии громаден. Более 15 тысяч киловатт-часов электроэнергии тратили, чтобы получить тонну HNO3. В 1904 году завод закрыли как нерентабельный.
Азотная кислота была совершенно необходима и для агрохимических производств, и для получения взрывчатки, но слишком уж дорогой ценой давалась кислота с берегов Ниагары.
В годы первой мировой войны появились первые заводы, на которых получали окислы азота, окисляя аммиак на платиновом катализаторе. Та же реакция: 4NH3 + 5O2 = 4NO + 6Н2О - лежит в основе современного производства азотной кислоты. Расход энергии при этом примерно в 100 раз меньше, чем при получении окислов азота в вольтовой дуге.
Окисление аммиака кислородом воздуха в присутствии платины происходит при температуре 700-900° С. Катализатором служат сетки из тонкой платиновой проволоки. Для увеличения ее прочности к платине добавляют родий.
Химизм процесса можно представить так. К поверхности платины молекулы кислорода подходят уже ослабленными: ковалентная связь О-О расшатана высокой температурой. На платине эта связь рвется, и начинается взаимодействие с образованием связей Pt-О. Довольно быстро вся платина покрывается кислородом. Но молекулы аммиака, находящиеся тут же, рвут эти новые непрочные связи. С кислородом, активированным платиной, реагируют и водород, и азот, составляющие молекулы аммиака. Образовавшиеся окислы - Н2О и NO - адсорбируются на платине значительно слабее и смываются с катализатора газовым потоком. А на освободившуюся платину оседают, связываясь с ней, другие атомы кислорода, взаимодействующие затем с новыми молекулами аммиака. Вышедшая из контактного аппарата окись азота окисляется кислородом до высших окислов азота (NO2, N2O3, N2O4), которые при взаимодействии с водой дают азотную кислоту.
Реакция окисления аммиака до NO без побочных реакций идет только на платине. На катализаторах из других металлов идут процессы с образованием других продуктов (закись азота N2O, элементарный азот и другие вещества), непригодных для получения кислоты.
Сейчас в мире ежегодно производят на платиновых катализаторах десятки миллионов тонн азотной кислоты. Это производство потребляет примерно треть мировой добычи платины (без СССР), около шести с половиной тонн в год.
ПЛАТИНА И НЕФТЕХИМИЧЕСКИЙ СИНТЕЗ
Второй основной потребитель (около 4 тонн платины в год) - нефтехимический синтез.
Подсчитано, что из нефти сейчас получают более 5000 разнообразных продуктов. Платина помогает сделать многие из них, причем сделать в больших количествах и наиболее рациональным путем.
Процессы каталитического платформинга [*] нефтепродуктов получили распространение в последние два десятилетия. В 1911-1913 годах Николай Дмитриевич Зелинский обнаружил, что , в присутствии платины шестичленные нафтеновые углеводороды претерпевают реакции с отщеплением водорода (дегидрируются, как говорят химики). Позже 21 было установлено, что в результате таких реакций могут образовываться ароматические углеводороды - бензол, толуол, ксилол и их производные, представляющие огромную ценность и сами по себе, и как сырье для многих синтетических продуктов.
Небольшие таблетки диаметром в 2-3 мм и высотой 4-5 мм. Они сделаны из окиси алюминия, на которую нанесена мелкодисперсная платина. Содержание ее невелико - 0,5-0,8% по весу. Так выглядит катализатор для процессов платформиига.
 В присутствии элемента № 78 происходят сложнейшие превращения углеводородов. В реактор поступают, к примеру, бензиновые фракции нефти, бензины с низким октановым числом, а выходят из него бензины высших сортов. Или всегда дефицитный бензол. Или другие ароматические углеводороды - незаменимое сырье для синтеза каучука, нейлона, полиэфирных волокон, различных смол и пластмасс.
В присутствии элемента № 78 происходят сложнейшие превращения углеводородов. В реактор поступают, к примеру, бензиновые фракции нефти, бензины с низким октановым числом, а выходят из него бензины высших сортов. Или всегда дефицитный бензол. Или другие ароматические углеводороды - незаменимое сырье для синтеза каучука, нейлона, полиэфирных волокон, различных смол и пластмасс.Мощность установок для каталитической переработки нефтепродуктов растет с каждым годом. И с каждым годом растет потребность нефтехимии в платине.
Механизм катализа в реакциях нефтехимического синтеза (да и во многих других) выяснен не до конца. Очевидно, что и здесь, как в процессе окисления аммиака, образуются промежуточные продукты с исчезающе малым временем жизни. Эти промежуточные продукты представляют собой комплексные соединения платины, распад которых приводит к образованию целевых продуктов, например ароматических углеводородов.
ПЛАТИНА И ПРИБОРОСТРОЕНИЕ
Третий главный потребитель платины - приборостроение. Его доля - тоже около 4 тонн в год.
Стабильность электрических, термоэлектрических и механических свойств платины плюс высокая коррозионная стойкость и тугоплавкость сделали ее исключительно привлекательным материалом для изготовления множества различных деталей в наиболее ответственных узлах современных приборов и механизмов.
Вот несколько примеров.
В процессе выращивания многих полупроводниковых кристаллов решающее значение имеет поддержание точного температурного режима в течение длительного времени. Поэтому здесь используют нагреватели из платины или ее сплавов с родием и иридием. Такие сплавы позволяют получать температуру до 1500-1700° С и регулировать ее с точностью ± 1° С...
Широкое применение находит платина в технике измерения высоких температур (до 1500° С) в качестве превосходного материала для термометров сопротивления и термопар.
Сплав платины с вольфрамом используют в приборах для определения мощности работающих реактивных двигателей и турбин. Датчикам этих приборов приходится работать в среде агрессивных отходящих газов при температуре 600°С.
Из платиново-иридиевого сплава (25% иридия) делают неокисляемые контактные устройства. При многочисленных размыканиях и замыканиях образуются искры и вольтовы дуги. Контакты корродируют, оплавляются, иногда привариваются друг к другу, особенно при сильных токах. Чтобы исключить возможность таких явлений, делают контакты из платины. Не везде и не всегда, разумеется. Платино-иридиевые контакты устанавливают, к примеру, в авиационных двигателях. Значительно чаще (для экономии платины) применяют платинированные контакты. Тонкую платиновую пленку наносят на другие металлы. И эти контакты используют лишь там, где малейшие изменения электрических характеристик недопустимы (вычислительные устройства, ракетная техника)...
...И ДРУГИЕ
Мы рассказали лишь о некоторых областях применения платины и «израсходовали» уже около 14 тонн. Еще 2-3 тонны платины расходует химическая промышленность на аппаратуру для получения многих особо чистых веществ и фторсодержащих соединений. Около трех тонн этого металла ежегодно потребляет мировая стекольная промышленность: из сплавов платины с 5-10% родия делают фильеры для производства стеклянного и кварцевого волокна. В сосудах из платины и ее сплавов выплавляют специальные сорта особо чистого стекла, предназначенные для квантовой электроники и оптики.
Издавна большим спросом пользуется платина и в ювелирном деле. Мягкий белый цвет платиновой оправы усиливает игру бриллианта, камень кажется крупнее и изящнее, чем в оправе из золота или серебра.
Но доля ювелиров при распределении платины становится все меньше. Ведь даже на небольшую оправу для камня приходится тратить около грамма платины — количество, достаточное для получения полутора тонн азотной кислоты или нескольких десятков тонн высококачественного моторного топлива...